西门子医疗 战略全布局丨万字长文 AI (西门子医疗战略建议)
近期,雷锋网医健AI掘金志邀请西门子医疗高级研发科学家于扬,做客雷锋网公开课,以“大道至简,深入解析西门子医疗智慧影像链”为题,对西门子医疗的全流程影像AI解决方案进行了解析。
后续将有更多课程上线,添加微信公众号 医健AI掘金志 报名听课,或收看本节课程视频回放
1990年,西门子就已经将AI应用在设备成像中。西门子医疗高级研发科学家于扬表示,虽然AI近些年在辅助诊断中取得了很好的效果,但这只是影像科工作链上的一个点。在AI应用上,西门子医疗提出一种全流程智慧影像链的解决方案,将人工智能融合到影像设备操作流程和科室工作之中,提供全科室的精准医疗服务。
以CT扫描前的患者位置选择为例,西门子医疗研发了Alpha自动解剖结构识别技术,自动标记扫描区域,消除人为操作可能产生的误差,准确性达到99%;
在扫描环节中,其自动管电流和电压调节技术可以根据患者体型,辅助技师选择最佳的扫描参数条件。
针对扫描后的医生诊断环节,西门子医疗提出了前处理理念。以心脏扫描为例,将过去需要15分钟时间才能完成的心脏分割,冠脉提取,处理分析等后处理工作,在西门子前处理工作站下后自动完成,当医生打开病例时,对应的结果和分析报告就会自动呈现出来。
以下为于扬分享的全文内容,雷锋网做了不改变原意的编辑。
我主要想谈一谈西门子医疗智慧影像链在CT检查和诊断中的应用。在开始介绍之前,我想先跟大家分享几个数字:截止到2019年底,全国CT装机量已经达到5600台,并且这个数字还在以每年16%的速度增长,
另一方面,目前在中国注册的影像相关诊断医生,包括技师和护士在内,总共只有15.8万人,相当于每百万人口中只有11个影像医生、这个群体的增长速度只有2.2%,远没有CT的增长速度快,这样的不平衡会引发很多的问题。

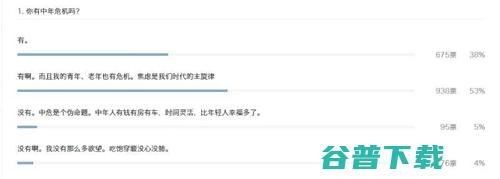
第1点,医生工作量的增加。据统计,一个医生每天要平均处理50个患者的影像数据,阅读25000张到50000张的医学图像,加班已经成了医生的家常便饭。
第2点,患者就诊的感受也不是很好。曾经有报道说患者需要等上好几天才能拿到自己的诊断报告。
第3点,工作量增加,还被证实会导致诊断水平准确性的下降。有些研究表明如果将医生工作时的处理时间缩短一半,那么诊断的错误率才有可能会提高16.6%。
所有的一切都构成了医学影像发展中的新挑战。如何解决这些挑战?我想很多人心目中都会想到这样的一个答案,用人工智能方法帮助医生减少工作压力、提高工作效率。

从两三年前开始,人工智能再次回到我们热议讨论的中心。这个时候开始有大批的初创公司将目光聚焦于此,由此衍生出很多应用,比如说肺结节的筛查分析、乳腺癌筛查、眼底糖网筛查、术中鉴别的辅助诊断,这些应用很多都是应运而生。
但回过头来看,在投资蜜月期结束之后,真正被临床接受、被NMPA认可、具有稳定的临床表现的这种应用产品却寥寥可数。
为什么会出现这样的情况?其实我们分析有认为有以下三点的原因:
第1个, AI的优势在于对明确逻辑或者是特定规则下进行学习和预测。而对于疾病诊断来说,很多诊断指南还在更新和完善的过程中,很多所谓的临床金标准的可信度也没有达到百分之百。这就使我们学习和预测模型的准确性,在想达到准确性很高的程度时,会有较大的难度。
第2个,我们之前关注的过于局限。回过头来看,过去大家可能将太多的目光关注在了辅助诊断上。这并没有错,但医学影像是一个非常长的工作链条,我们不应仅仅关注在一个点上,而是应该从整体的角度想办法来提高工作效率。
第3,很多研究也都证实,决定AI算法准确性的核心在源头:数据的采集是否规范、数据的标准是否统一、数据的质量是不是满足要求。
这些是AI成败的关键,这也从侧面说明,要从整体角度去思考AI对于影像工作流程影响的重要性。

正是基于这样的想法,西门子医疗提出了一种全流程智慧影像链的解决方案。
西门子医疗在全流程创新方面,是将人工智能的思想融合到影像设备的操作流程以及影像科工作的工作流程之中。为科室提供全系列的影像产品的同时,辅助操作技师和影像医生提供快速个性化和定制化的精准医疗服务。
对CT来说,这个代表着什么呢?整个CT的检查流程的环节特别多,而且会涉及到众多工作人员,同时还需要科室间配合的辅助检查过程。
比如说在扫描之前,医护人员需要对患者进行准备,对扫描手段进行设置。如果是做心脏扫描的话,还需要对患者的心率进行评估。

在扫描过程中,首先需要对检查进行检测、复核,然后还需要根据患者的情况选择合适的扫描方案、扫描条件,甚至还需要对异常的情况进行处理。
扫描结束后,医生也需要对数据进行后处理的分析,包括阅片、撰写诊断报告等这些工作。
我们可以把这个过程分为扫描、重建、后处理和诊断等四个环节。
每一个环节中都有很繁琐的操作,人工智能的方法和技术确实可以帮助我们。值得一提的是,在每一个环节中CT的操作指南以及诊断指南都进行了严格的规范。
西门子医疗的智慧影像链内嵌入的AI算法完全满足指南要求,可以提供一个规范化的扫描过程进行高质量重建,包括自动的前处理,以及精准的辅助诊断以及辅助诊断的结果。


举一个简单的例子,比如说对近些年来备受关注的肺结节筛查,指南中对患者的摆位,包括扫描范围都有很明确的界定。
扫描技师需要通过学习和训练来掌握这些细节。然而即便如此,摆位的偏差、扫描位置偏移,依然是存在的。技师间操作个体的差异是在所难免,也是无法消除的。
这就导致整个审核过程中的不规范和不准确的问题存在。这样一个简单的环节,对辐射剂量、图像质量都会产生很大的影响。通过人工智能的方法就可以很好的解决这个问题。

上图所示就是利用人工智能的方法和我们手动标记的自动扫描区域的一个比较示例。
我们看到白色线是手动勾画的扫描区域,而橘黄色线是人工智能算法自动标记出来的一个扫描区域,手动设置的扫描区域,它或大或小比较不稳定,而自动标记设定的区域它是永远是统一的。
所以人工智能自动标记的过程,消除了人为操作可能产生的误差,同时也减少了医生的不必要的工作。

这个可以通过西门子独有的基于人工智能的Alpha自动解剖结构识别技术来实现。
和大多数的人工智能识别方法类似,它也是通过对大量手动标记的数据进行系统学习,然后建立起人工智能的学习模型,来学习解剖结构的一些定位信息,后面再利用这个模型在新的数据上给出这些解剖结构相应位置。
为了更好的适应我们中国人群相关解剖结构的特点,了解中国人群的需求,我们也特地选取亚洲人群的数据库,进行整个模型的训练。所以对中国人群的识别准确度、敏感度都是非常好。

这个技术被紧密的结合在了很多西门子医疗智慧影像链的工作链条之中,我们看到它的准确性可以达到99%,而敏感性可以达到97%以上,可以说是一个非常好的表现。

在扫描环节中,除了上面讲到的自动识别功能外,扫描参数的设定也是非常重要的一个环节。
我们现在看到的这个图,是我们在ct界面上对所有扫描参数的一些设置。这个设计的过程是相当复杂的,它的复杂程度绝对要高于一台高品质的单反相机的设置,其中有数十个参数需要调节。
并且技师还需要针对不同体型的人群,调节相关参数来获得稳定的图像质量,以及造影剂的相应增强水平。
这都非常考验技师的能力,即便拥有丰富经验的技师也可能会犯错误,因为相同的体型,体脂含量、骨骼的密度都可能不同。仅凭肉眼对体型进行判断非常难实现我们要求的标准化。

而且这个问题对于高端的CT来说就会变得更为复杂。普通CT可能只有4个球管电压档位:80kV、100kV、120kV、140kV,而球管电流的选择范围也有可能只是从0~600/700mA这样的选择范围。
而目前西门子最高端的双源CT,参数的调节能力就更强。千伏我们现在是有9档的选择,从70kV到150kV,每10千伏有一个选项。而电流的选择,我们可以从0~1300mA,是相当于其他CT4倍的选择范围。
那么在这么多的可能性之中,哪一个才是最佳的扫描参数条件的设置?这个问题就会变得比较复杂。

为了解决这个问题,我们在西门子CT上研发了自动的管电流和管电压的调节技术。这两个技术会通过患者的定位相来衡量患者的体型,以及扫描部位来选择最合适的一个电压。
而且整个调节过程在扫描过程中是实时改变的,在360度的扫描过程中,这项技术可以通过在患者前一个投照角度下的密度来自适应的来调节我们的电流水平。
这样就真正做到了按照患者的自身情况,个性化的设计扫描方案的过程。并且为了保证对于不同患者,我们的图像质量能够统一,可以通过设定图像质量的参考值来保证无论对于什么样的患者、什么样的体型进行扫描,都可以得到稳定和统一的图像。

这个例子展示了在使用我们电流调节技术之前和使用电流调节技术之后图像上的差异。
我们可以看到在肩部以及肩锁的部位,没有使用调节之前,它的伪影是非常严重的。而使用了这个技术之后,在投照方向上会感知这种密度的增强,会自动调高我们的电流的相应水平。所以我们看到在右面的图像上,它的这种伪影是非常少的,图像质量是满足我们临床需求的。
另外一方面,大规模的人群使用下来的统计结果,这种技术确实也可以帮助我们对整个人群的辐射剂量管理起到一定的帮助。
比如我们看到在没有使用 care技术之前,大部分人群会采用120kV进行扫描。而使用了care技术之后,大部分人群我们辐射剂量、辐射的水平大幅度降级,大部分的人群是采用100kV进行扫描,而且获得的图像质量是一致的。这其实就是扫描参数的自动设置给我们带来的一些新的改变。

那么除了这个以外,在图像质量控制方面,也是智能化的一个重要应用领域。
心脏扫描可以说是整个CT扫描最重要的检查之一了,同时也是对图像质量的把控需求最高的一个环节。
那么这其中其实也蕴含着人工智能技术的相应扶持。心脏检查之所以复杂,是因为我们在对一个运动器官进行成像,就好像是我们在拍一个运动的风车,需要扫心脏的CT扫描仪有一个非常快的扫描速度。
西门子采用两套球管两套探测器的双源设计,同时采集来缩短心脏扫描的成像时间。我们现在已经可以做到66毫秒的单扇区时间分辨率。
但是单单硬件上的这种领先还是不够的。在做冠脉扫描的时候,尤其是针对这种冠心病的患者,还会经常出现这种心律不齐的情况。那么对于这种心脏不规则的运动,就需要我们用智能的方法来帮助我们,保证我们图像质量了。这就是我后面想介绍到的ACS自适应心脏扫描的智能方法。

我们看到在正常的心率下,可以通过一些心电图信号的导引,稳定的采集到两次心跳中间收缩末期和舒张末期我们想要的数据。
而对于正常的心率来说,这个其实是没有任何问题的。当我们面对早搏或者心律不齐的患者时,如果没有ACS的辅助,采集的数据就会过晚而错过我们最佳的采集时间窗口。会导致整个图像的模糊或者运动伪影,整个检查就是失败的。
而如果使用了自适应的心脏采集方式,我们可以看到它会自动分析前三次的心跳,来预测下一次心跳的到来时间。当遇到心律不齐的情况时候,它会自动打开全计量曝光,并且延长整个曝光时间的长度,来解决心律不齐的患者导致数据无法重建这样的问题。

从一个例子来看一下,这个患者就是连续的发生了两次早搏,ACS算法都成功的探测到了早搏的存在,并且终止了当时的扫描。
在下一次正常心跳来临的时候,重新进行了新的扫描,并且延长了整个扫描的一个曝光窗口。我们从重建的图像中也可以看到,重建的图像结果并没有受到早搏的影响。

同时在我们最新的系列产品之上,其实还有很多智能应用,包括对造影剂照相机安全的控制应用,包括对辐射剂量安全控制的应用,都被我们集成在扫描控制的一个iPad平板电脑之上,以确保我们可以获得一个安全标准的扫描结果。可以来进入到后续面的后处理,包括重建以及后处理的一些环节。

在重建的环节中,其实早期我们并没有用到人工智能技术。但随着这个技术的发展,来到迭代重建时代,基于模型的技术就会越来越多的应用到我们整个重建过程当中。
比如说我们第1代的SAFIRE迭代重建,它其实是对真实的原始数据以及前投影获得的原始数据进行比较,通过两个比较来降低我们的整体噪声,包括图像的一个伪影问题。
在比较的过程中,其实就涉及到了系统的模型,模拟的是整个x射线投照,包括整个探测器吸收的一个过程。这里头其实我们就已经用到了人工智能的这种模型的概念,而在我们最新一代的迭代算法 ADMIRE上,人工智能模型的应用就会更加丰富。

在ADMIRE上,我们用到了系统模型、解剖结构感知模型、原始数据与统计模型以及噪声模型,4种不同的模型。这些模型的使用是迭代算法,我们获得的图像质量有了一个显著的提升。
与最原始的FBP的重建色彩相比,ADMIRE迭代重建能在保持信息值不变的条件下显著的降低图像的噪声,提高整个图像的信噪比。而且是在低对比度的一个情况下,ADMIRE能够明显的提升小病灶的显示水平和检出率。

除此之外,ADMIRE迭代重建算法还可以用来帮我们降低整体的辐射剂量。
那么可以看到这个例子就是在相同的辐射计量水平下,我们使用不同的重建算法,最终得到的图像的比较。很明显没有使用任何迭代算法的WBP重建,它的图像质量是非常差的。
当我们使用的这种人工智能的模型之后,我们发现SAFIRE中间迭代的结果图像会好很多。而最新的基于4种模型的 ADMIRE系统,重建后他的图像质量就会非常好,整个肺内的组织显示,包括纹理的显示,其实都达到了我们临床诊断的一个水平。
而且值得一提的是,它的辐射剂量真的是非常低,只有0.025 mSv,我们会把这样的方法用在肺结节的筛查上,确保患者辐射计量的安全。
除此之外,为了更好的显示数据,在西门子3D显示的过程中,我们还在业界首次使用了仿生成像的技术。这种仿生成像技术,可以对西门子CT的数据进行高频次的三维还原。仿真程度我们可以和实物相比。
除了这个技术建立在我们西门子CT图像高空间分辨率、高密度分辨率以及3D的一个优势基础之上,其实与以往的三维成像技术相比,还更多地运用了这种人工智能的光学模型算法。
比如说我们看到的MontCarole模拟的方法,包括次表面散射的重建算法,这些重建算法可以帮助我们更好的显示这些解剖结构中的一些细节,同时增加这些组织结构在三维图像上深度的信息。
这样的优势带来了很多改变。
首先其可以用于教学的环节。比如对一些教学医院,我们可以用这样的数据来指导学生对解剖结构的认知。除此之外,对于临床来说,其实这样的数据也更有利于我们对整个的患者情况进行显示。

我们现在看一个对比,这个是没有 cvrt这个技术之前,我们进行的三维显示。而有了这种cvrt这个技术之后,我们可以看到整个颅骨骨折的细节显示是非常细致的。
其次这样的技术我们还可以将它用在整个手术的规划过程之中,做手术的虚拟导航。甚至这样的技术由于对于小结构,包括小血管的显示非常细腻,所以它也被用来对一些疾病提出一些新的诊断和一些指征。比如说我们对于克罗恩病去观察它的微小血管,可以提出一个新的诊断的指征标准。

按照常规的流程,所有我们获得的数据,包括重建的这些结果,最后都会被传输到医生的阅片工作站上。但是在西门子的CT系统之上会有所不同。
除了刚才看到的这些数据,包括后处理这些三维显示的结果之外,其实还有更多的惊喜。我们分析结果的数据也会自动的展示在我们的阅片平台之上。像这个就是西门子最著名的前处理的功能。

比如我们拿心脏扫描为例,正常的工作流程,一般来说诊断医生会在扫描之后先调阅患者的平扫图像,来评估它的钙化积分,对心脏的钙化情况进行估计。然后第二步还需要将增强的图像调阅出来,对整个患者的心脏进行分割,冠脉束进行提取,来评估患者的冠脉的狭窄情况。
那么接下来如果患者还进行了比如灌注扫描的话,那么医生还需要手动的将灌注数据调阅出来,导入在我们的后处理工作站中,再对灌注的数据进行分析,来评估它的心功能的情况。
而如果是在我们西门子的系统上进行分析数据做后处理,那么这些所有的过程会都被自动完成。扫描之后,所有的处理都会自动的实现。当我们打开这个病例的时候,所有刚才提到的这些分析的结果,包括分析的报告,都会自动的呈现在医生的面前。
那么对于以往我们可能要花15分钟完成的数据分析的任务,但是在西门子前处理这样的平台和思想之下,我们一步就可以完成,可以做到扫描结束即处理即所得。医生不用花那么多的时间浪费在我们整个复杂的后处理环节中,而是可以把更多的时间放在患者身上,去研究患者的病情。

类似这样的前处理操作,其实还有很多针对临床上的操作,西门子的后处理Inline技术都可以自动完成。甚至所有这些后处理的结果都可以传输到我们的阅片平台上,非常方便医生的分析和读取。
比如说对于肋骨骨折的判断,我们Inline的重建会自动把肋骨提取出来,并且将肋骨拉平进行平铺显示,方便医生更好的找到骨折线的位置,这样的结果是明确并且一目了然的。

而对于一些更为复杂的诊断需求,可能就需要用到我们更复杂更高级的辅助分析软件了。比如如果医生想对心肌缺血的情况进行判断,那么常规的这种冠脉检查,虽然我们可以看到冠脉结构,但是对于血管代偿的存在,它不能直接的判断和分析我们心肌缺血的情况。
相比之下血流储备分数可能会是对缺血判断更准确一点的参数,但是这是一种有创的检查方式,临床开展相对较少。
所以在这种情况下,医生如何去判断患者的真实情况?
对于这样的问题,西门子开发了一个基于CT图像的血流储备分数的一个评估的模型。通过对动脉束的建模,包括利用到这种仿真的、基于流体力学的血流压力的这些数据,我们可以训练出一个自动的来评估血流储备分数的一个计算机模型。
利用计算机模型,我们在新的数据上就可以在很短的时间内获得对血流储备分数的一个估计值。这样的一个基于人工智能的血流储备分数模型,它的好处有以下几点:
第1个,运算速度是非常快的。我们在几秒钟的时间内就可以获得原来可能需要有创方式才能获得的结果。
第2点,无需我们额外的操作。我们在常规的这种冠脉的增强图像上进行处理,就可以得到这样一个结果,无需我们再做额外的一个检查。
第3个,准确性很高。这种模拟得到的数据的结果跟我们真正的这种有创获得的结果,它的相近度是非常高的。
所以这样就可以真正在临床使用过程中帮助我们提供额外的辅助诊断信息,而且这些辅助诊断的信息对于冠心病患者确实帮助是非常之大的。

这些信息我们可以将它利用在对缺血的真实性的判断上。比如患者到底要不要真正的进行这种PCI的一个治疗,对这方面我们如何去预测,其实我们都可以利用这样的数据,在基于传统CTA的数据支持基础之上,我们可以把 CT-FFR的数据结合到我们整个的诊断路径之中。
也有研究分析也讨论过,如果将这种CT-FFR的数据加入到整个我们的诊断逻辑之后,将会改变60%以上受试者的治疗推荐,可以减少很多不必要的支架的植入,这对患者是非常大的帮助。
这个结论以被多家医院所证实,来自国外的多中心研究中收集了5000多例这样的数据,最终得出了这样的结果。辅助诊断其实对于冠心病患者的 PCI术后的预测是有很大的价值。

除此之外,其实这样的CAD辅助诊断预测模型在我们的西门子系统之上还有很多。比如说我们现在看到的对于卒中缺血区域分析的这样一个评估,ASPECTS评分的这样一个工具,它可以自动的对颅脑进行区域的划分,并且评估出缺血的ASPECTS的参数。

还有比如说我们有对肿瘤患者的良性,甚至是肿瘤的淋巴结转移可能性预测的分析软件。基于CT的纹理特征的数据,我们建立起这种组学分析的模型,可以很有效的预测包括肿瘤良恶性,是否转移,甚至包括它的基因表现的一些特点。
那么除此之外,对于这种肺结节的筛查,也是我们比较传统的一个应用了。我们也提供了这种肺结节筛查的工具,可以自动标记肺结节的位置,对肺结节进行轮廓的分割,帮助医生更快速的找到病灶的一个位置,给医生更多的一个提示。

还有一个值得大家关注的方面,就是在我们的科研平台上,近期我们还会推出一个肺的炎性评估的一个科研的软件。它对于整个新冠肺炎的评估会有很好的帮助作用。

上面就是给大家展示的智能化和数字化技术在整个西门子医疗影像链中的应用,可以看到人工智能技术其实贯穿到了所有的流程之中,并且相互配合、紧密衔接。针对不同的临床检查目的,会形成各自不同的影像链的决策束。
比如说我们现在看到的对于心脏来说,其实我们不仅仅是关注在诊断的一个环节中。
从最开始讲,如何去扫描?如何去准备患者?如何去保证诊断的准确性?这些从源头开始,我们就在利用整个人工智能的方法来帮助我们获得更准确的数据,来帮助我们获得更准确的诊断结果。除此之外,对于肺结节、对于卒中来说,我们也都会形成不同的智慧影像链的这种决策束。
这样的智慧影像链确实给我们带来了很大的改变,我们可以看到前后的对比。没有智慧影像链之前,可能医生大部分的时间都会集中在热力图的显示,医生大部分时间会集中在他的操作间,在电脑和显示器面前去进行复杂的设置和操作。
而如果利用到我们这种人工智能技术之后,医生可以把大部分的时间放在与患者的沟通,包括对病情的了解,人工智能可以让医生从复杂的工作中抽身,把时间更多的放在与患者的交流之中。
那么就是整个智慧影像链在扫描环节中,可能会对我们整个医学影像带来的一些新的改变。

最后,我们还想在这个基础之上,跟大家探讨分享一下我们对未来人工智能发展的一些思考。
人工智能它是一个非常大的趋势,但是如何将其跟医学影像结合,才能让它更快、更好的落地?

西门子在这方面有了很深入的思考,我们给出了西门子对于人工智能的发展的一个框架。
这里面可能我们要做的有两件事情:
第1,就是刚才介绍到的全流程的智慧影像链,让人工智能的方法真正的结合到我们整个从数据采集到和重建后处理以及诊断每一个环节之中,更好的提高我们医生的诊断效率,提高诊断的准确性。
第2,我们还是更关心疾病,更关心患者的健康。如何利用人工智能技术来提高疾病的诊断效率、疾病的准确性,这个才是我们可能更为关心的一个问题。所以我们关注在以患者为中心,以疾病为中心的诊疗路径的优化上。

西门子在这个方面也是有独家优势的。比如以心脏为例,围绕心脏相关的疾病,西门子就提供了全面的医疗产品。无论是这种介入的产品和医学的产品或核磁、CT、超声,包括检查室的产品,我们都有非常丰富的产品线。

其实可以帮助我们去探索一些我们之前可能没有触及到的灰色地带。比如对心肌缺血来说,有研究表明对于如果FFR数值介于0.7和0.8之间对于心肌缺血的判断准确性会有明显下降,形成一个“灰色”的诊断地带。

其实可以帮助我们去探索一些我们之前可能没有触及到的灰色地带。比如还是以刚才讲到的心肌缺血的问题来看,有研究表明对于如果冠脉CT-FFR这个参数在0.7和0.8之间,这是一个整个判断,也是心肌缺血的一个灰色的地带。

那么如果我们可以综合的利用多种参数来共同评估,其实它评估的准确性会更高一些。比如有研究表明,我们同时利用FFR数值,包括CFR数值以及微循环的数值同时对血管进行评估,它整个预测包括急性冠脉综合征以及未来不良事件的风险和准确性都会高很多。
而这些不同的这些参数,其实都是我们利用西门子的不同影像设备可以做到并获得的数据。这是我们未来的一个方向,要利用多模态的采集方式,利用多模态数据共同分析的方法,来帮助我们更好的提高诊断的水平。

那么不单单是在心脏方面,在整个的肿瘤的分析方面,我们也可以综合的利用CT、核磁,包括核医学这样的数据来进行统一的分析。

那么对于比如说神经方面,现在也有非常明确的诊断的流程。我们利用CT的数据可以进行这种颅脑的灌注,利用核磁的数据可以看到我们脑组织的一些变化,利用 DSA的数据可以看到我们整个血管的一些走形变化,包括堵塞的变化。
我们可以利用全方面所有的影像设备里影像设备提供这些数据,对这些疾病做一个全方位的诊断。这是我们整个的基于单病种智慧治疗路径优化的整个思考方式。

那么这些思路也得到了整个西门子硬件方面的一些支持,包括整个数据的分析和分享。我们可以通过这样一个系统,打破各个科室之间数据分享的一个壁垒,然后获得数据的共享。

除此之外,在西门子的所有的系统之上,我们还率先推广了数字化的结构报告。对于不同的诊断结果,我们都可以采用这种结构化的数字化的方式进行存储,方便我们后期对数据的分析,包括对数据的查找。
而且对于整个人工智能来说,数据的一个标准化,包括它的一个结构化,也是对于我们后期做数据挖掘非常重要的基础。

西门子投入了大量的精力在开发人工智能的发展方面,目前已经拥有人工智能应用达到了40多项,并且拥有自己的医学诊断的数据库,进行人工智能算法的开发,并且我们还有大型的这种基础的设备来进行运算力的一个支持。
2018年,我们公司还斥巨资打造了 digital health solution数字医疗解决方案这样的部门,我们会专注在人工智能产品的设计和研发的工作上,和更多医生和客户致力于人工智能的应用。
原创文章,未经授权禁止转载。详情见 转载须知 。